Trong lĩnh vực hóa học, chúng ta thường chia thành các loại oxit, axit, bazơ, oxit axit và oxit bazơ. Mỗi loại này sẽ có các đặc điểm và tính chất khác nhau. Sau khi tìm hiểu về khái niệm của oxit, hôm nay hãy cùng hoccungthukhoa.vn tìm hiểu oxit bazơ là gì? Tính chất và đặc điểm của oxit bazơ.
- Tác Hại Kali Bromat Trong Bánh Mì & Cách Nhận Biết Bánh Mì Chứa Kali Bromid
- Khái Niệm Momen Quán Tính & Momen Quán Tính Ảnh Hưởng Bởi Những Yếu Tố Gì?
- Bật Mí Các Tác Hại Của Nước Tẩy Javen Và Những Lưu Ý Khi Sử Dụng
- Vị Trí Các Hành Tinh Trong Hệ Mặt Trời: Tìm Hiểu Thứ Tự Và Đặc Điểm
- Màng Pe Là Gì? Ứng Dụng Của Màng Pe
1. Tìm hiểu oxit bazơ là gì – phần khái niệm
Oxit bazơ là một khái niệm quan trọng trong lĩnh vực hóa học, và để hiểu rõ hơn về nó, chúng ta cần tìm hiểu phần khái niệm. Oxit bazơ là những hợp chất chứa một hoặc nhiều nguyên tử kim loại kết hợp với một hoặc nhiều nguyên tử oxy và có tính bazơ tương ứng.
Bạn đang xem: Tìm Hiểu Oxit Bazơ Là Gì? Cách Đặt Tên, Tính Chất Và Các Loại Bài Tập
Tại sao chúng ta cần tìm hiểu về oxit bazơ là gì? Điều này là vì oxit bazơ có sự xuất hiện phổ biến trong cuộc sống hàng ngày của chúng ta. Chẳng hạn, oxit bazơ được sử dụng để làm gạch, men sứ, thuốc nhuộm và cảm ứng màu trong công nghệ điện tử. Để hiểu tại sao và làm thế nào oxit bazơ có thể được sử dụng trong những ứng dụng này, chúng ta cần hiểu rõ về tính chất và đặc điểm của oxit bazơ.
Ngoài ra, chúng ta cũng cần biết về các loại oxit khác như oxit trung tính và oxit lưỡng tính. Oxit trung tính là những oxit không phản ứng với nước để tạo ra axit hoặc bazơ, và không phản ứng với bazơ hoặc axit để tạo ra muối. Ví dụ như CO và NO. Trong khi đó, oxit lưỡng tính là những oxit phản ứng với dung dịch axit và dung dịch bazơ để tạo ra muối và nước. Ví dụ như Al2O3 và ZnO. Hiểu rõ về các loại oxit này giúp chúng ta nhận biết và phân loại chúng theo tính chất và ứng dụng tương ứng.

Phân loại:
- Oxit bazơ tan là oxit bazơ của các bazơ kiềm hoặc bazơ kiềm thổ
- Oxit bazơ không tan là oxit bazơ của các kim loại khác như Fe, Cu… và các oxit của các kim loại khác.
Ngoài ra, còn có loại oxit trung tính và oxit lưỡng tính:
- Oxit trung tính là những oxit không phản ứng với nước để tạo ra axit hoặc bazơ, không phản ứng với bazơ hoặc axit để tạo ra muối. Ví dụ như CO, NO…
- Oxit lưỡng tính là những oxit phản ứng với dung dịch axit và dung dịch bazơ để tạo ra muối và nước. Ví dụ như Al2O3, ZnO…
2. Cách gọi tên oxit bazơ như thế nào?
– Đặt tên oxit: tên nguyên tố kết hợp với từ “oxit”
Ví dụ: NO là oxit nitơ, BaO là oxit bari

Cách gọi tên oxit bazơ phụ thuộc vào loại kim loại và hóa trị của nó.
- Nếu kim loại có hóa trị cố định như Fe với hóa trị II, III, thì ta đặt tên bằng tên kim loại theo sau là hóa trị kèm theo chữ “oxit”.
Ví dụ: FeO đọc là oxit sắt II, Fe2O3 đọc là oxit sắt III.
- Nếu là phi kim có nhiều hóa trị, tên của oxit sẽ là tên phi kim kèm theo tiền tố chỉ số nguyên tử phi kim, kết hợp với từ “oxit” và tiền tố chỉ nguyên tử oxit.
Ví dụ: P2O5 đọc là oxit photpho V, Cl2O7 đọc là oxit clo VII.
Nhờ cách gọi tên này, chúng ta có thể dễ dàng nhận biết và phân loại các oxit bazơ dựa trên thành phần và hóa trị của chúng.
3. Các tính chất hóa học của oxit bazơ
3.1. Tác dụng với nước
Chỉ có oxit bazơ của kim loại kiềm và kiềm thổ có thể tác dụng với nước. Các oxit bazơ tác dụng với nước bao gồm: K2O, Na2O, CaO, BaO, Li2O, Rb2O, SrO…
Công thức chung có thể thể hiện như sau:
R2On + nH2O -> 2R(OH)n
Ở đây, n đại diện cho hóa trị của kim loại R
R(OH)n là chất tan trong nước, và dung dịch thu được được gọi chung là dung dịch bazơ hoặc dung dịch kiềm. Các dung dịch bazơ này thường làm giấy quỳ tím chuyển sang màu xanh và làm cho phenolphtalein từ không màu chuyển sang màu hồng.
Xem thêm : Tìm Hiểu Nitơ Là Gì – Tính Chất, Quá Trình Tạo Ra Và Ứng Dụng Của Nitơ
K2O + H2O -> 2KOH
Na2O + H2O -> 2NaOH
BaO + H2O -> Ba(OH)2
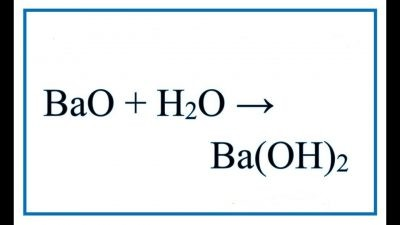
3.2. Tác dụng với axit
Hầu hết các oxit bazơ tác dụng với axit để tạo ra muối và nước. Hầu hết các oxit bazơ đều có thể tác dụng được với axit.
Công thức chung có thể thể hiện như sau:
Oxit bazơ + axit -> Muối + H2O
Ví dụ, có thể phản ứng như sau:
BaO + 2HCl -> BaCl2 + H2O
Fe2O3 + 3H2SO4 -> Fe(SO4)3 + H2O
3.3. Tác dụng với oxit axit
Một số oxit bazơ tác dụng với oxit axit để tạo ra muối. Thông thường, đây là các oxit có thể tan trong nước.
Công thức có thể được biểu diễn như sau:
Oxit bazơ + oxit axit -> Muối
Ví dụ với các phản ứng sau:
CaO + CO2 -> CaCO3
BaO + SO4 -> BaSO3
4. Các dạng bài tập về oxit bazơ

4.1. Dạng 1 – Xác định công thức của oxit bazơ
- Bước 1: Đặt tên công thức oxit bazơ cần tìm trong một kim loại hoặc nguyên tố được nêu trong đề bài, hoặc nếu không có thông tin về kim loại.
- Bước 2: Tính các số liệu liên quan
- Bước 3: Dựa vào kết quả thu được, viết phương trình hóa học
- Bước 4: Lập phương trình hóa học dựa trên tỷ lệ
Ví dụ: Cho 4,48 gam một oxit của một kim loại với hóa trị II tác dụng hết với 7,84 gam axit sunfuric H2SO4. Sau đó, xác định công thức của oxit trên.
- Hướng dẫn giải chi tiết
Gọi công thức oxit cần tìm là MO vì kim loại có hóa trị II
Xem thêm : Vai Trò Dicalcium phosphate: Bổ Sung Chất Dinh Dưỡng Hiệu Quả!
n(H2SO4) = 0,08 mol, n(MO) = 4,48 (M + 16)
Ta có phương trình:
MO + H2SO4 -> MSO4 + H2O
Theo đề bài: 4,48 (M + 16) = 0,08 => M = 40
Vậy M là Ca, vậy oxit cần tìm là CaO.
4.2. Dạng 2 – Tính toán oxit bazơ tác dụng với dung dịch axit
Trường hợp 1:
Oxit bazơ + dung dịch axit sunfuric H2SO4 loãng -> Muối sunfat + nước
Ví dụ:
Na2O + H2SO4 -> Na2SO4 + H2O
Nhận xét: Các phản ứng hóa học trên có điểm chung là khi chuyển từ oxit thành muối sunfat, mỗi mol axit sunfuric tham gia phản ứng sẽ làm tăng khối lượng muối. Từ đó, có thể có công thức:
R + 16 gam -> (R + 96) gam -> sinh ra 1 mol H2O hoặc 1 mol H2SO4. Từ đó có công thức:
Muối sunfat = m(oxit) + 80n H2SO4
FAQ – Những thắc mắc liên quan đến Tìm hiểu oxit bazơ là gì
1. Oxit bazơ có ảnh hưởng gì đến cuộc sống hàng ngày của chúng ta không?
Oxit bazơ là những hợp chất chứa oxi và kim loại kiềm hoặc kim loại kiềm thổ, có tính kiềm. Chúng được sử dụng rất phổ biến trong cuộc sống hàng ngày của chúng ta. Ví dụ, oxit bazơ được dùng để làm gạch, men sứ, thuốc nhuộm và cảm ứng màu trong công nghệ điện tử.
2. Tại sao oxit bazơ có tính kiềm?
Oxit bazơ có tính kiềm là bởi vì chúng chứa nhóm hydroxide (OH-). Nhóm hydroxide này có khả năng chấp nhận ion hydro (H+) từ nước và làm tăng nồng độ ion hydroxide (OH-) trong dung dịch. Điều này làm cho oxit bazơ trở thành một chất có tính kiềm.
3. Oxit bazơ có an toàn để sử dụng không?
Oxit bazơ có thể an toàn khi sử dụng ở nồng độ thấp. Tuy nhiên, khi tiếp xúc với các dung dịch kiềm mạnh như NaOH và KOH, oxit bazơ có thể gây ăn da và kích ứng. Vì vậy, khi sử dụng oxit bazơ, chúng ta nên tuân thủ các biện pháp bảo hộ như đeo găng tay và mắt kính.

Hy vọng bài viết về Tìm Hiểu Oxit Bazơ là gì đã cung cấp cho bạn những kiến thức mới và hữu ích về chủ đề này. hoccungthukhoa.vn muốn khuyến khích các bạn để lại nhận xét và ý kiến của mình về bài viết. Cùng chia sẻ bài viết này để lan tỏa thông tin bổ ích đến nhiều người hơn nhé. Chúng tôi rất đánh giá cao sự tương tác và chia sẻ của bạn. Cảm ơn đã theo dõi và hẹn gặp lại bạn trong những bài viết tiếp theo.
Nguồn: https://hoccungthukhoa.vn
Danh mục: Giáo Dục








Leave a Reply