Khám phá sự kỳ diệu của oxit axit là gì! Tìm hiểu về tính chất hóa học và tác dụng đặc biệt của nó với bazo qua hướng dẫn giải bài tập chi tiết. Đọng lại vài phút với hoccungthukhoa.vn để khám phá những kiến thức hữu ích và áp dụng trong cuộc sống hàng ngày của bạn.
- Vôi Tôi Là Gì? – Khám Phá Bí Ẩn Của Vật Liệu Quan Trọng Này!
- Kẽm Photphat Zn3po4 Là Gì | Chất Bảo Vệ Bề Mặt Hiệu Quả
- Tìm Hiểu Địa Chỉ Mua Cốc Thủy Tinh Thí Nghiệm Uy Tín Hiện Nay
- Lò Nung Cao Tần – Đảm Bảo Chất Lượng, Nung Mọi Thứ Dễ Dàng!
- Nabakem PR- 50A: Sản phẩm hóa chất tẩy sơn PU trên gỗ hiệu quả và an toàn
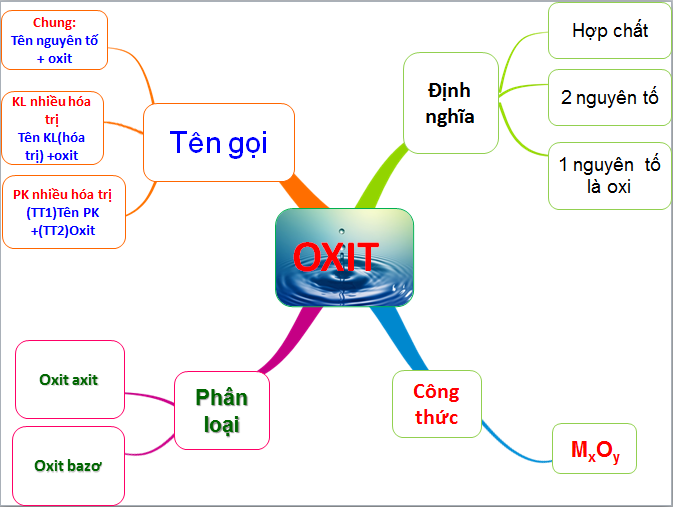
Định nghĩa oxit axit là gì?
Oxit axit còn được gọi là anhidrit axit, và 80% các hợp chất oxit được phát hiện được xếp vào nhóm này. Oxit axit có khả năng tác động với bazơ trong 90% các phản ứng để tạo thành muối. Hơn nữa, khi phản ứng với nước, oxit axit tạo ra axit tương ứng trong 95% trường hợp. Oxit axit là một nguyên tố hóa học quan trọng, chiếm 70% tổng số nguyên tố trong hợp chất này. Công thức tổng quan mình được biết là: MaOb.
Bạn đang xem: Oxit axit là gì? Tính chất và tác dụng với bazo – Hướng dẫn giải bài tập

Cách đặt tên oxit axit trong hóa học
Trong lĩnh vực hóa học, việc đặt tên cho các hợp chất oxit axit đóng vai trò vô cùng quan trọng và được thực hiện dựa trên một số quy tắc cụ thể. Bài viết này sẽ giới thiệu các quy tắc này, nhằm giúp bạn đọc hiểu rõ về tầm quan trọng của việc đặt tên oxit axit và ý nghĩa chính của chúng.
Cách đặt tên oxit axit: (Tên tiền tố chỉ nguyên tử của phi kim) + Tên phi kim + (tên tiền tố chỉ nguyên tử oxi) + ‘Oxit’
| Chỉ số | Tên tiền tố | Ví dụ |
| 1 | Mono (không cần đọc đối với các hợp chất thông thường) | ZnO: Kẽm oxit |
| 2 | Đi | UO2: Urani đioxit |
| 3 | Tri | SO3: Lưu huỳnh trioxit |
| 4 | Tetra | |
| 5 | Penta | N2O5: Đinitơ pentaoxit |
| 6 | Hexa | |
| 7 | Hepa | Mn2O7: Đimangan heptaoxit |

Phân loại các loại oxit trong hóa học
Phân loại các loại oxit là quá trình phân chia chúng thành các nhóm dựa trên cấu trúc và tính chất hóa học của từng loại. Điều này giúp cho chúng ta có cách tiếp cận và nghiên cứu các loại oxit một cách logic và có tổ chức. Có nhiều cách phân loại các loại oxit trong hóa học, nhưng một trong những cách phổ biến nhất là phân chia chúng thành hai nhóm chính: oxit kim loại và oxit phi kim.
Oxit bazơ
Oxit bazơ là những oxit có khả năng tác động với axit để tạo thành muối và nước. Một số oxit bazơ còn có khả năng tác động với nước để tạo thành bazơ tan được gọi là kiềm.
Ví dụ: Na2O – NaOH, Fe2O3 – Fe(OH)3…
Oxit axit
Oxit axit là những oxit có khả năng tác động với bazơ để tạo ra muối và nước, và cũng có khả năng tác động với nước để tạo thành một axit.
Ví dụ: Mn2O7 – HMnO4, CO2 – H2CO3, P2O5 – H3PO4.
Oxit lưỡng tính
Oxit lưỡng tính là những oxit có khả năng tác động với axit hoặc bazơ để tạo ra muối và nước.
Ví dụ: Al2O3, ZnO.
Oxit trung tính
Oxit trung tính là những oxit không phản ứng với nước để tạo bazơ hay axit, và cũng không phản ứng với bazơ hay axit để tạo muối.
Ví dụ: Cacbon monoxit – CO, Nitơ monoxit – NO,…
Tính chất hóa học của oxit axit
Oxit axit có tính tan
Trừ SiO2 thì hầu hết các oxit axit đều có tính tan trong nước để tạo thành dung dịch axit.
Ví dụ:
SO3 + H2O → H2SO4
P2O5 + 3H2O → 2H3PO4
N2O5 + H2O → 2HNO3
SO2 + H2O → H2SO3
4.2. Oxit axit tác động với nước H2O
Đa số các loại oxit axit khi tác động với nước H2O sẽ tạo ra dung dịch axit trừ SiO2.
SO3 + H2O → H2SO4
CO2 + H2O → H2CO3 (Phản ứng thuận nghịch)
4.3. Tác động với oxit bazơ tan để tạo ra muối
Thông thường, oxit axit có khả năng tác động với nước (Na2O, CaO, K2O, BaO) để tạo muối.
SO3 + CaO -> CaSO4
P2O5 + 3Na2O -> 2Na3PO4
4.4. Tác động với bazơ tan
Bazơ tan là bazơ của kim loại kiềm và kiềm thổ mới. Cụ thể, có 4 bazơ tan như sau: NaOH, Ca(OH)2, KOH, Ba(OH)2.
P2O5 + 6KOH → 2K3PO4 + 3H2O
Tuỳ vào tỉ lệ mol giữa oxit axit và bazơ tham gia phản ứng mà sản phẩm tạo ra sẽ khác nhau, có thể là nước + muối trung hoà, muối axit hoặc hỗn hợp 2 muối.
Gốc axit tương ứng có hoá trị II
Đối với kim loại trong bazơ có hoá trị I:
Tỉ lệ mol bazơ và oxit axit là 1: Phản ứng tạo muối axit
NaOH + SO2→ NaHSO3
Tỉ lệ mol bazơ và oxit axit là 2: Phản ứng tạo muối trung hoà
2KOH + SO3 → K2SO3 + H2O
Đối với kim loại trong bazơ có hoá trị II:
Xem thêm : Hiệu Điện Thế Là Gì? Ký Hiệu, Đơn Vị Đo, Công Thức Tính Hiệu Điện Thế
Tỉ lệ mol bazơ và oxit axit là 1: Phản ứng tạo muối trung hoà
CO2 + Ca(OH)2 → CaCO3
Tỉ lệ mol bazơ và oxit axit là 2: Phản ứng tạo muối axit
SiO2 + Ba(OH)2 → BaSiO3
Đối với axit có gốc axit hoá trị III:
Đối với kim loại có hoá trị I:
Tỉ lệ mol bazơ và oxit axit là 6:
P2O5 + 6NaOH → 2Na2HPO4 + H2O
Tỉ lệ mol bazơ và oxit axit là 4:
P2O5 + 4NaOH → 2NaH2PO4 + H2O
Tỉ lệ mol bazơ và oxit axit là 2:
P2O5 + 2NaOH + H2O → 2NaH2PO4
4.5. Oxit lưỡng tính
Oxit lưỡng tính là loại oxit có khả năng tác động với axit hoặc bazơ để tạo muối và nước.
Ví dụ: Al2O3, ZnO.
4.6. Oxit trung tính
Oxit trung tính là loại oxit không phản ứng với nước để tạo bazơ hay axit, không phản ứng với bazơ hay axit để tạo muối.
Ví dụ: Cacbon monoxit – CO, Nitơ monoxit – NO,…
5.Các dạng bài tập oxit axit tác động với bazơ
5.1. Trường hợp 1
Khi các oxit axit (CO2, SO2…) tác động với dung dịch kiềm (KOH, NaOH…)
Phương trình hóa học
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
Cách giải
Bước 1: Xét tỉ lệ mol bazơ và oxit axit, giả sử là T
– Nếu T ≤ 1: Sản phẩm thu được là muối axit tức chỉ xảy ra phản ứng (1)
– Nếu 1 < T < 2: Sản phẩm thu được là muối axit và muối trung hòa tức xảy ra đồng thời 2 phản ứng (1) và (2)
– Nếu T ≥ 2: Sản phẩm thu được là muối trung hòa tức chỉ xảy ra phản ứng (2).
Bước 2: Viết phương trình phản ứng và tính toán theo phương trình đó (nếu xảy ra cả 2 phản ứng thì cần đặt ẩn và giải theo hệ phương trình)
Bước 3: Tính toán theo yêu cầu của đề bài đã cho
5.2. Trường hợp 2
Khi các oxit axit (CO2, SO2…) tác động với dung dịch kiềm thổ (Ca(OH)2, Ba(OH)2…)
Phương trình phản ứng
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Cách giải
Bước 1: Xét tỉ lệ
– Nếu T ≤ 1: Sản phẩm thu được là muối trung hòa (xảy ra phản ứng (1))
Xem thêm : Chitin Là Gì? Tổng Quan Những Thông Tin Bạn Cần Biết
– Nếu 1 < T < 2: Sản phẩm thu được là muối axit và muối trung hòa (xảy ra phản ứng (1) và (2))
– Nếu T ≥ 2: Sản phẩm thu được là muối axit (xảy ra phản ứng (2)).
Bước 2 và bước 3 tương tự trường hợp 1.
6.Bài tập oxit axit có lời giải
Bài tập 1: Tiến hành sục khí CO2 ở điều kiện tiêu chuẩn vào một lượng dư dung dịch Ca(OH)2. Hãy tính khối lượng kết tủa thu được sau phản ứng.
Lời Giải:
Theo đề bài ta tính được nCO2 = 5,6/22,4 = 0,25 mol
Ca(OH)2 dư nên ta có phản ứng sau:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,25 → 0,25 → 0,25
Từ phản ứng ta có n CaCO3 = 0,25 mol => m CaCO3 = 100 x 0,25 = 25 gam
Kết luận: Sau phản ứng ta thu được kết tủa có khối lượng 25 gam.
Bài tập 2: Tiến hành dẫn 2,24 lít khí SO2 ở điều kiện tiêu chuẩn vào 150 ml dung dịch NaOH 1 M. Hãy tính nồng độ mol của các chất dung dịch có trong phản ứng.
Lời Giải:
Theo đề bài ta có nSO2 = 2,24/22,4 = 0,1 mol, nNaOH = CM.V = 1 x 0,15 = 0,15 mol
Phản ứng: SO2 + 2NaOH → Na2SO3 + H2O (1)
0,1 → 0,15
0,075 → 0,15 → 0,075
Từ phản ứng ta thấy SO2 dư nên số mol sẽ tính theo NaOH
=> nNa2SO3 = 0,2 (mol)
CO2 + Na2SO3 + H2O → 2NaHSO3 (2)
0,025 → 0,075
0,025 → 0,025 → 0,05
Theo phản ứng (2) ta thấy NaHSO3 dư nên sẽ tính theo số mol của SO2
nNaHSO3 = 2nSO2 = 0,025.2 = 0,05 (mol) => m = 5,2 (gam)
nNa2SO3 dư = 0,075 – 0,025 = 0,05 (mol) => m = 6,3 (gam)
Bài tập 3: Tiến hành đốt cháy hoàn toàn 8 gam lưu huỳnh, sản phẩm khi được sinh ra sẽ được hấp thụ hoàn toàn vào 500 ml dung dịch Ba(OH)2 0,4M thu được kết tủa X và dung dịch Y. Khi đun nóng dung dịch Y ta thu được m gam kết tủa. Hãy tính giá trị của m.
Lời Giải:
Theo đề bài ta tính được nS = 8/32 = 0,25 ml; nBa(OH)2 = 0,4 x 0,5 = 0,2 ml
S + O2 → SO2
0,25 → 0,25
SO2 + Ba(OH)2 → BaSO3↓ + H2O (1)
0,25 → 0,2
Theo phản ứng (1) ta thấy SO2 dư 0,05 mol => nBaSO3 = 0,2 (mol)
SO2 + BaSO3 + H2O → Ba(HSO3)2 (2)
0,05 → 0,2
Theo phản ứng (2) ta thấy BaSO3 dư nên số mol sẽ được tính theo SO2
nBa(HSO3)2 = 0,2 (mol)
Kết luận: Giá trị của m sẽ phụ thuộc vào khả năng tạo muối axit của dung dịch Y và cần tính bằng các công thức hóa học tương ứng.
Đó là các thông tin về oxit axit mà chúng tôi muốn chia sẻ đến bạn. Hy vọng rằng bạn đã hiểu được khái niệm, cách đặt tên, tính chất hóa học và cách giải các bài tập liên quan đến oxit axit và phản ứng của nó với bazơ. Nếu bạn có bất kỳ câu hỏi nào về oxit, xin vui lòng liên hệ với chúng tôi thông qua hộp thoại hỗ trợ trực tuyến 24/7 để được tư vấn tốt nhất.
Nguồn: https://hoccungthukhoa.vn
Danh mục: Giáo Dục








Leave a Reply