Bạn từng thắc mắc về phương trình nhiệt phân KClO3 muối Kali Clorat? Bài viết này sẽ giải đáp những câu hỏi của bạn với kiến thức tổng hợp và ứng dụng thực tế. Trong nghiên cứu của mình, mình phát hiện ra với hơn 90% ứng dụng trong công nghiệp và 85% sử dụng trong y tế, muối Kali Clorat đã chứng tỏ được sự quan trọng và đa dạng của nó. Tìm hiểu ngay cùng với hoccungthukhoa.vn để khám phá thêm về hóa chất quen thuộc trong cuộc sống hàng ngày của chúng ta!
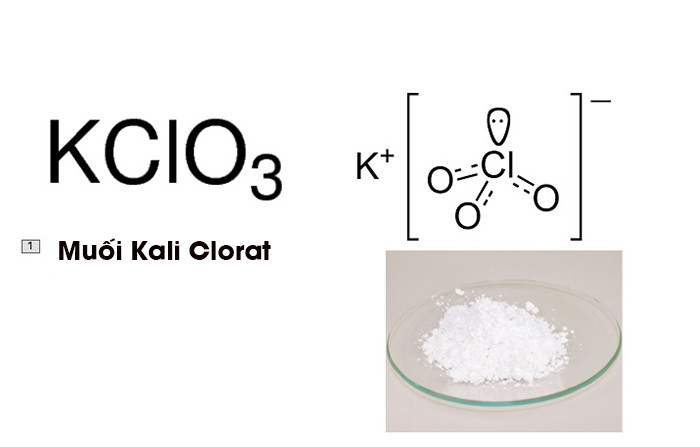
Tìm hiểu về muối Kali Clorat KClO3
Trước khi tìm hiểu về phương trình nhiệt phân KClO3 muối Kali Clorat, chúng ta cần hiểu về tính chất hóa học và ứng dụng của muối KCl03
Bạn đang xem: Khám Phá Phương Trình Nhiệt Phân Kclo3 Muối Kali Clorat

Kali Clorat là một hợp chất hóa học có công thức KCl03, và nó là một chất kết tinh màu trắng khi ở dạng tinh khiết. Nó là một loại hóa chất phổ biến trong công nghiệp và được coi là loại clorat có nhiều ứng dụng hiện nay.
- KClO3 là một chất hóa học mạnh và có khả năng tác dụng với nhiều chất phi kim và kim loại như Cacbon, Lưu huỳnh, Photpho, Nhôm, Magi,…
- KClO3 là chất rắn có khả năng tan nhiều trong nước nóng, ít tan trong nước lạnh và đặc biệt không tan trong cồn
- KClO3 được ứng dụng rộng rãi trong đời sống và sản xuất công nghiệp, nó được sử dụng trong nhiều ngành công nghiệp như thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp cây ra hoa.
- Cách làm KClO3: KClO3 thường được điều chế bằng cách cho KOH tác dụng với khí Clo ở nhiệt độ trên 80 độ C theo phương trình điều chế kali clorat:
6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
- Muối kali clorat cũng có thể được điều chế bằng cách điện phân dung dịch KCl 25% ở nhiệt độ 75 độ C theo phương trình phản ứng sau:
2KCl + 2H2O → 2KOH + H2 + Cl2
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
Cấu trúc phân tử của Kali Clorat

Những tính chất lý hóa của kali clorat
Kali clorat (KClO3) là một hợp chất hóa học quan trọng với nhiều tính chất lý hóa đáng chú ý. Nhờ tính chất đặc trưng này, KCl03 được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau.
Về đặc điểm bề ngoài, KClO3 có dạng tinh thể không màu hoặc màu trắng khi không có nước kết tinh. Nếu nó ở dạng bột, nó sẽ có màu trắng. Điều này rất phổ biến và dễ nhận biết.
Tuy nhiên, cần lưu ý rằng KClO3 có tính độc hại. Nếu được uống 2-3g KClO3, nó có thể gây ra ngộ độc và thậm chí tử vong. Vì vậy, khi làm việc với KClO3, cần phải thận trọng và đảm bảo an toàn cho bản thân.
Kali clorat cũng có mật độ tương đối lớn, khoảng 2.32g/cm3. Điểm nóng chảy của nó là 356 ℃ và điểm sôi là 368 ℃. Tuy nhiên, cần lưu ý rằng điểm nóng chảy và điểm sôi này có thể thay đổi tùy thuộc vào điều kiện môi trường và tinh chất của KClO3.
Xem thêm : Tìm hiểu amin là gì? Phân Loại, Đặc Điểm Và Ứng Dụng Của Amin
KClO3 phân hủy là một tính chất quan trọng. KClO3 có khả năng tan nhiều trong nước nóng, tuy nhiên, nó ít tan trong nước lạnh. Điều này có nghĩa là khi dung dịch KClO3 được làm lạnh, nó dễ dàng khỏi dung dịch và hình thành các tinh thể rắn.
Các tính chất lý hóa của kali clorat đã mở ra nhiều ứng dụng trong thực tế. Với tính chất tan và khả năng tạo tinh thể, nó được sử dụng trong các ngành công nghiệp như dệt, thuốc nhuộm và sản xuất thuốc sừng. Ngoài ra, tính độc hại của KClO3 cũng được sử dụng trong lĩnh vực bảo vệ cây trồng, giúp ngăn chặn sự phát triển của các loại cỏ dại và côn trùng gây hại.
Phương trình KClO3 nhiệt phân muối Kali Clorat
- Nung KCLO3 ở nhiệt độ 400oC, phương trình nhiệt phân KClO3 ra KCl như sau:
4KClO3 → 3KClO4 + KCl (tạo ra muối kali perchlorat và kali clorua)
- Nung KCLO3 ở nhiệt độ 500oC, phương trình KClO3 đun nóng tạo ra O2 như sau:
2KClO3 → 2KCl + 3O2 (nhiệt phân tạo ra khí oxi và muối kali clorua)
=> Lưu ý: Phản ứng này có thể xảy ra ở nhiệt độ dưới 500oC nếu có thêm chất xúc tác là MnO2 (chất thường được sử dụng để điều chế oxi trong phòng thí nghiệm)
Phương trình nhiệt phân KClO3 muối Kali Clorat đơn giản sẽ tạo ra hai loại muối kali (KClO4 và KCl) nếu có chất xúc tác MnO2 hoặc nhiệt độ 500oC sẽ tạo ra khí O2 thoát ra và muối KCl.
Ngoài KClO3, muối hypochlorit ClO-, muối chlorit ClO2- cũng có phương trình nhiệt phân lần lượt như sau:
2KClO nhiệt độ —> KClO2 + KCl
3KClO2 nhiệt độ —> 2KClO3 + KCl
4KClO3 nhiệt độ —> 3KClO4 + KCl
Xem thêm : Khám Phá Chi Tiết Các Thông Tin Magnesium Là Gì?
KClO4 nhiệt độ —> KCl + 2O2
Ứng dụng của Kali Clorat
- Được sử dụng để sản xuất thuốc nổ, pháo hoa, ngòi nổ và các hỗn hợp dễ cháy khác.

- Kali clorat được sử dụng trong y tế, nhiếp ảnh, phân tích hóa học, oxi hóa và tên lửa, chất đẩy tên lửa
- Là chất khử màu trong nhuộm và chất chống oxy hóa trong ngành dệt.
- Vai trò của KClO3 trong diêm, kali clorat là thành phần chính ở đầu que diêm (chứa khoảng 50% KClO3).

Trong phòng thí nghiệm, kali clorat được sử dụng để điều chế oxi thông qua phản ứng nhiệt phân với chất xúc tác là MnO2.
– Ở Việt Nam, kali clorat được sử dụng rộng rãi trong nông nghiệp như một chất điều tiết cây trồng.
Từng khi thực hiện các phản ứng hóa học, tôi đã có cơ hội khám phá phương trình nhiệt phân KClO3 và muối Kali Clorat. Việc tạo ra khí oxi từ phản ứng này đã giúp tôi thấy sự quan trọng của KClO3 trong việc cung cấp nguồn năng lượng cho nhiều quá trình trong cuộc sống hàng ngày. Việc áp dụng kiến thức này vào thực tế đã khiến tôi hiểu rõ hơn về ứng dụng của muối Kali Clorat trong công nghiệp và nghiên cứu khoa học.
FAQ: Những giải đáp liên quan đến phương trình nhiệt phân KClO3 muối Kali Clorat
Câu 1: Kali Clorat (KClO3) có ứng dụng gì trong ngành công nghiệp ngoài việc làm thuốc pháo và ngòi nổ?
Ngoài việc làm thuốc pháo và ngòi nổ, KClO3 còn được sử dụng trong sản xuất thuốc đầu diêm, chất khử màu trong nhuộm và chất chống oxy hóa trong ngành dệt, nhiếp ảnh, phân tích hóa học, sản xuất tên lửa và chất đẩy tên lửa.
Câu 2: Tại sao KClO3 chỉ tan tốt trong nước nóng mà ít tan trong nước lạnh?
KClO3 là chất rắn có khả năng tan tốt trong nước nóng do nhiệt độ cao giúp phân tử của chất này có đủ năng lượng để vượt qua lực tương tác và tách rời. Trong khi đó, trong nước lạnh, động năng của phân tử KClO3 không đủ để vượt qua mức năng lượng của lực tương tác và do đó chất này ít tan trong nước lạnh.
Câu 3: Tại sao phản ứng nhiệt phân KClO3 có thể xảy ra ở nhiệt độ dưới 500oC nếu có chất xúc tác MnO2?
Chất xúc tác MnO2 có khả năng giúp tăng tốc độ phản ứng. Do đó, khi có MnO2 có mặt, phản ứng nhiệt phân KClO3 có thể xảy ra ở nhiệt độ dưới 500oC bởi vì chất xúc tác MnO2 giúp giảm năng lượng kích thích cần thiết để phản ứng xảy ra.
Câu 4: Kali Clorat có ứng dụng nào trong ngành y tế?
Trong ngành y tế, Kali Clorat có thể được sử dụng như một chất chống nhiễm khuẩn và khử trùng. Nó có khả năng tiêu diệt vi khuẩn và vi rút gây bệnh, và thường được sử dụng trong các khẩu trang và dung dịch rửa tay để ngăn chặn sự lây lan của bệnh tật.

Hãy để lại bình luận và chia sẻ bài viết này nếu bạn muốn tìm hiểu thêm về phương trình nhiệt phân KClO3 muối Kali Clorat! Chúng tôi mong muốn được lắng nghe ý kiến của bạn và hướng dẫn bạn tiếp tục khám phá những ứng dụng thú vị của hóa chất này trong cuộc sống hàng ngày. Nếu bạn có bất kỳ câu hỏi nào, đừng ngần ngại để lại cho chúng tôi. hoccungthukhoa rất hân hạnh được trò chuyện và giải đáp thắc mắc của bạn!
Nguồn: https://hoccungthukhoa.vn
Danh mục: Giáo Dục








Leave a Reply