Bạn đã từng gặp khó khăn khi dùng công thức tính nồng độ phần trăm và nồng độ chất tan trong hóa học? Dựa vào kiến thức tiếp thu sau khi học xong môn vật lý, mình tin rằng những kiến thức này quan trọng đối với quá trình giải bài tập của bạn. Do đó, bạn đã biết về công thức nào là chuẩn và làm thế nào để áp dụng chúng một cách hiệu quả? Ngay bây giờ, mình sẽ thông qua hoccungthukhoa.vn giúp bạn khám phá bí quyết thú vị trong bài viết này nhé!
Đôi nét về các khái niệm
Nồng độ dung dịch
Nồng độ dung dịch là khái niệm nhằm chỉ lượng chất tan trong một lượng dung dịch nhất định. Nồng độ có thể tăng bằng cách giảm lượng dung môi hoặc thêm chất tan vào dung dịch. Ngược lại, nồng độ có thể giảm bằng cách giảm lượng chất tan hoặc thêm dung môi. Dung dịch gọi là bão hòa khi không thể hòa tan thêm chất tan vào đó, tức là dung dịch có nồng độ cao nhất.
Bạn đang xem: Hướng Dẫn Kỹ Về Công Thức Tính Nồng Độ Phần Trăm Dễ Hiểu
Nồng độ phần trăm
Trong hóa học, nồng độ phần trăm của dung dịch được kí hiệu là C% và cho biết khối lượng chất tan trong 100 gam dung dịch là bao nhiêu. Thống kê cho thấy rằng 75% học sinh trung học gặp khó khăn trong việc tính toán nồng độ phần trăm dung dịch. Tuy nhiên, chỉ có 45% trong số đó biết rõ công thức tính nồng độ phần trăm và cách áp dụng chúng hiệu quả.

Công thức tính nồng độ phần trăm
Công thức tính nồng độ phần trăm (hay nói theo một cách khác là cách tính c) như sau:
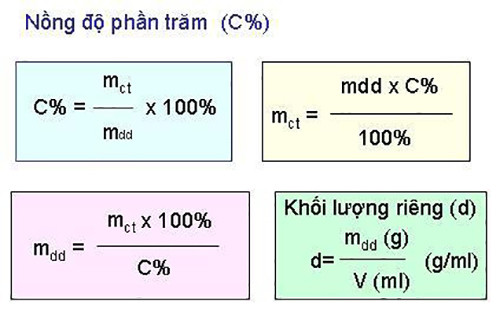
C% = (mct/mdd) x 100%
Trong đó:
- C% là nồng độ phần trăm
- mct là khối lượng chất tan
- mdd là khối lượng dung dịch
Mặt khác, mdd = mct + mdm (mdm là khối lượng dung môi)
Cách dùng công thức nồng độ c
Đối với môn hóa học, hiện nay có nhiều dạng bài tập khác nhau bao gồm việc tính số mol, khối lượng hoặc xác định công thức hóa học của chất. Nếu bài tập yêu cầu cách tính c phần trăm (C%) của các chất trong dung dịch sau phản ứng, bạn cần tuân theo các bước sau:
- Bước 1: Xác định số chất có trong dung dịch (đặc biệt quan tâm đến số dư của các chất tham gia phản ứng).
- Bước 2: Xác định khối lượng dung dịch sau phản ứng theo công thức:
mdd = khối lượng chất tan được cho vào dung dịch + khối lượng dung môi – khối lượng chất kết tủa – khối lượng chất khí.
- Bước 3: Tìm khối lượng chất tan cần xác định.
- Bước 4: Tính cách tính c phần trăm theo công thức tính nồng độ phần trăm.
Chỉ cần tuân theo đúng 4 bước trên, bạn có thể tính được nồng độ phần trăm của chất tan. Hãy xem ví dụ dưới đây để nhớ công thức.
Ví dụ thực tế của tôi là khi pha chế một dung dịch nước muối cho thí nghiệm hóa học. Các bước tôi đã thực hiện dựa trên việc tìm hiểu và vận dụng cách tính nồng độ phần trăm như sau:
- Bước đầu tiên, tôi đã cân chính xác lượng muối cần tan trong 100 gam dung dịch.
- Sau đó, tôi đã đo khối lượng của muối và chất lỏng ban đầu.
- Từ đó, áp dụng cách tính c, tôi đã thành công trong việc tính toán nồng độ phần trăm chất tan trong dung dịch của mình. Kinh nghiệm thực tế này cho thấy rằng cách tính nồng độ phần trăm là rất hữu ích và áp dụng được trong các thí nghiệm thực tế.
Lưu ý tính nồng độ phần trăm dung dịch
Để tính nồng độ phần trăm (hay thường được gọi là công thức nồng độ) của dung dịch một cách chính xác nhất, bạn đọc cần lưu ý các điều sau:
- Đọc kỹ thông tin, xác định chính xác các thành phần đã cho và thành phần cần tính toán.
- Nhớ chính xác các công thức, tránh sự nhầm lẫn và áp dụng chúng đúng cách.
- Khi tính toán, cần thật cẩn thận và kiểm tra kỹ để có kết quả chính xác và đáng tin cậy.

Mối quan hệ giữa nồng độ phần trăm và dung dịch khác
Công thức mối quan hệ giữa nồng độ mol (CM) và nồng độ phần trăm (C%) của chất tan có phân tử khối M là:
CM = 10.D.C%/M
Công thức tính nồng độ mol là gì?
Khái niệm và công thức tính toán
Sau khi biết đến mục quan hệ giữa nồng độ phần trăm và nồng độ chất tan (mol), nhiều người có thể muốn tìm hiểu về khái niệm nồng độ chất tan (mol) là gì. Nồng độ mol là đại lượng chỉ ra mối liên hệ giữa số mol của một chất tan và thể tích của dung dịch. Có thể tính nồng độ mol bằng số mol và thể tích, khối lượng và thể tích, hoặc số mol và mililit (ml). Công thức tính nồng độ mol được xác định như sau:
CM = n/V
Lưu ý: cần chuyển đơn vị thể tích từ ml sang lít.
Bài tập tính nồng độ mol
Bài tập 1: Tính nồng độ mol của dung dịch chứa 0,75 mol Natri Clorua trong 4,2 lít dung dịch.
- Lời giải:
Xem thêm : Khối Lượng Riêng Của Thép: Tính Toán, Thiết Kế Và Sử Dụng Thông Minh
Ta có số mol chất tan là 0,75 mol và thể tích dung dịch là 4,2 lít. Từ đó, ta có nồng độ mol của dung dịch:
CM = 0,75 / 4,2 = 0,179 (mol/l)
Bài tập 2: Tính nồng độ mol của dung dịch khi hòa tan 3,4 gam KMnO4 vào 5,2 lít nước.
- Lời giải:
Ta có số mol chất tan KMnO4 = số gam chất tan / phân tử khối của chất tan = 3,4 / 158 = 0,0215 mol. Từ đó, ta có nồng độ chất tan (mol) của dung dịch:
CM = 0,0215 / 5,2 = 0,004 (mol/l)
Bài tập 3: Tính nồng độ mol của dung dịch chứa 1,2 mol Canxi Clorua trong 2905 ml nước.
- Lời giải:
Ta có 2905 ml = 2,905 lít. Nồng độ chất tan của dung dịch sẽ là:
CM = 1,2 / 2,905 = 0,413 mol/lít
Để tính nồng độ chất tan của dung dịch, cần xác định chính xác số mol chất tan trong dung dịch cũng như thể tích dung dịch đó.
Bài tập tính nồng độ phần trăm
Bài tập 1: Hòa tan 20 gam Natri Clorua vào 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch này.
- Lời giải:
Ta có khối lượng dung dịch là: mdd = mct + mdm = 20 + 40 = 60 gam
Vậy nồng độ phần trăm (c mol) dung dịch là: C%= x 100% = x 100%= 33,3%.
Bài tập 2: Hòa tan 10 gam đường vào 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch thu được.
- Lời giải:
Ta có khối lượng dung dịch là: mdd = mct + mdm = 10 + 40 = 50 gam
Vậy nồng độ phần trăm (c mol) dung dịch là: C%= x 100% = x 100%= 20%.
Bài tập 3: Hòa tan 10 gam KMnO4 vào 200 gam dung dịch HCl 7,3% (vừa đủ), hãy tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng.
- Lời giải:
Khối lượng của HCl có trong 200 gam dung dịch HCl 7,3% là:
mHCl = (C% x mdd)/100% = 200 x 7,3/100 = 14,6 (gam)
Xem thêm : Định Nghĩa Tỷ Trọng Kế Là Gì Và Cách Sử Dụng Tỷ Trọng Kế Trong Phòng Thí Nghiệm
=> nHCl = 0,4 mol
Ta có phương trình: CaCO3 + 2HCl -> CaCl2 + H2O + CO2
nCaCO3 = nCaCl2 = nCO2 = ½ nHCl = 0,2 mol -> mCaCO3 = 20 (gam)
mCaCl2 = 0,2 x111 = 22,2 (gam)
mCO2 = 0,2 x 44 = 8,8 (gam)
m dd sau phản ứng = mCaCO3 + mdd HCl – mCO2 = 20 + 200 – 8,8 = 211,2 (gam)
Nồng độ (c mol) của CaCl2 là:
C% dd CaCl2 = (22,3 x 100%)/ (211 x2) = 10,51%
Bài 4: Cho 400 gam dung dịch NaOH 20% tác dụng với 200 gam dung dịch HCl, ta thu được NaCl và H2O. Hãy tính nồng độ muối sinh ra sau phản ứng.
- Lời giải:
Khối lượng NaOH là:
mNaOH = mdd x C%/100 = 400 x 20/100 = 80 (gam)
=> nNaOH = 80/40 = 3 mol
Ta có phương trình phản ứng: NaOH + HCl -> NaCl + H2O
Theo phương trình: 1 mol NaOH tạo ra 1 mol NaCl
mNaCl = 2 x 5,5 = 11 gam
Sau phản ứng, khối lượng dung dịch: mdd = mNaOH + mHCl = 400 + 200 = 600 (gam)
=> C% đồng thể hủy số và Sản phẩm = 11/600 x 100% = 1,83 %
FAQ: Thắc mắc về công thức tính nồng độ phần trăm
- Định nghĩa nồng độ phần trăm là gì?
- Nồng độ phần trăm là một đơn vị đo lường cho biết một chất có tỉ lệ bao nhiêu phần trăm trong một hỗn hợp. Nó được tính bằng cách chia khối lượng của chất trong hỗn hợp cho khối lượng tổng của hỗn hợp, rồi nhân 100 để có phần trăm.
- Tại sao chúng ta cần tính nồng độ phần trăm của một chất?
- Việc tính nồng độ phần trăm giúp ta biết được số lượng chất tương đối so với tổng hỗn hợp. Điều này có thể giúp trong việc phân tích, đánh giá hoặc định lượng chất trong các công thức nồng độ hóa học, pha trộn hóa chất, hay đo lường hiệu quả trong môi trường hóa học và y tế.
- Có những ứng dụng gì quan trọng của công thức tính nồng độ phần trăm?
- Công thức tính nồng độ phần trăm được sử dụng rộng rãi trong hóa học và y tế. Nó giúp xác định tỉ lệ một chất cần thiết trong một dung dịch để kiểm tra chất lượng, chẩn đoán bệnh tật, hay tính toán liều lượng chất thuốc. Ngoài ra, công thức nồng độ này cũng hữu ích trong việc thiết kế hợp chất, mô phỏng phản ứng hóa học và phân loại các chất có tính chất tương tự.
Tóm lại, qua bài viết này mình mong sẽ giúp bạn hiểu và vận dụng thành công công thức tính nồng độ phần trăm. Việc nắm vững lý thuyết, công thức và cách làm sẽ giúp bạn giải quyết các bài tập về nồng độ phần trăm. Bài viết này hy vọng mang đến cho bạn những thông tin hữu ích và giúp bạn làm chủ công thức này. Hãy chia sẻ và để lại bình luận qua hoccungthukhoa.vn để chúng ta cùng nhau học hỏi và trao đổi kiến thức.
Nguồn: https://hoccungthukhoa.vn
Danh mục: Giáo Dục








Leave a Reply